Lebenszyklus von Software für das Gesundheitswesen: Vorschriften für den US-Markt
Ein effektiver Prozess ist bei der Entwicklung von Software für das Gesundheitswesen von großer Bedeutung, da es sich hierbei um ein unternehmens- und sicherheitskritisches Projekt handelt.
Einführung
Sichere und zuverlässige Software für das Gesundheitswesen muss nach einem Entwicklungsprozess entwickelt werden, der von einer Aufsichtsbehörde genehmigt wurde. Dies lässt sich leicht durch die Einhaltung einer Prozessnorm wie der IEC 62304 [1] für die Medizin- und Gesundheitsbranche erreichen. Im Rahmen des jeweiligen Regelungsbereichs gibt es in der Regel weitere alternative Normen. Die FDA beispielsweise hat in ihren regulatorischen Anweisungen eine Prozessanleitung.
Es liegt auf der Hand, dass Qualität, Sicherheit und Zuverlässigkeit für die Entwicklung von Medizin- und Gesundheitssystemen entscheidend sind. Entsprechende Qualitätsstandards von FDA, EMDD, IEC 62304, ISO 60601/61010 (Sicherheit und Leistung) [3], ISO 14971 (Risikomanagement) [4], ISO 13485 (Qualitätsmanagement) [5], IEC 62366 [6] und andere ISO/IEC/FDA-Normen erfordern:
- vollständige Rückverfolgbarkeit der Anforderungen bis zur Produktfreigabe;
- anwendung ausgereifter und transparenter Methoden und Prozesse;
- geeignete Prüf- und Risikomanagementmaßnahmen;
- umfassende Dokumentation der Lebenszyklusprozesse für Konformitätsaudits.
Grundregelsatz
Die Einhaltung einschlägiger Normen der Medizinbranche beweist die Sicherheit und Zuverlässigkeit der Produkte und kann eine notwendige Voraussetzung für den Markteintritt sein. Die wichtigste Norm ist IEC 62304 (Medical Device Software - Life Cycle Processes) [1], die die Entwicklung von Software für Medizin- und Gesundheitssysteme regelt und beschreibt. Der Weg zu einer erfolgreichen Produktentwicklung ist zyklisch und iterativ, denn jede Idee wird prototypisiert, getestet, verbessert, erneut getestet, optimiert und verfeinert.
Nach Angaben der FDA entfällt der größte Teil des gesamten Produktlebenszyklus im Gesundheitswesen auf die Softwareentwicklung vom Konzept bis zur Vermarktung. Der Weg zu einer erfolgreichen Geräteentwicklung ist zyklisch und iterativ, da Ideen als Prototypen entwickelt, getestet, verbessert, erneut getestet, optimiert und verfeinert werden. Der Entwicklungspfad ist ein Kontinuum mit Rückkopplungsschleifen und Geräteänderungen (Abb. 1). Obwohl der Prozess in einzelne Phasen wie präklinische und klinische Phasen unterteilt ist, überschneiden sich die Phasen der Produktentwicklung und Teile davon müssen möglicherweise wiederholt werden, wenn Tests und Benutzererfahrungen in Produktänderungen einfließen und das Gerät sich seiner Marktform nähert. Darüber hinaus werden Produktbewertungen und -änderungen auch nach der Markteinführung des Produkts vorgenommen. In der Zwischenzeit finden Produktbewertungen und -änderungen auch dann noch statt, wenn das Produkt bereits auf dem Markt ist.
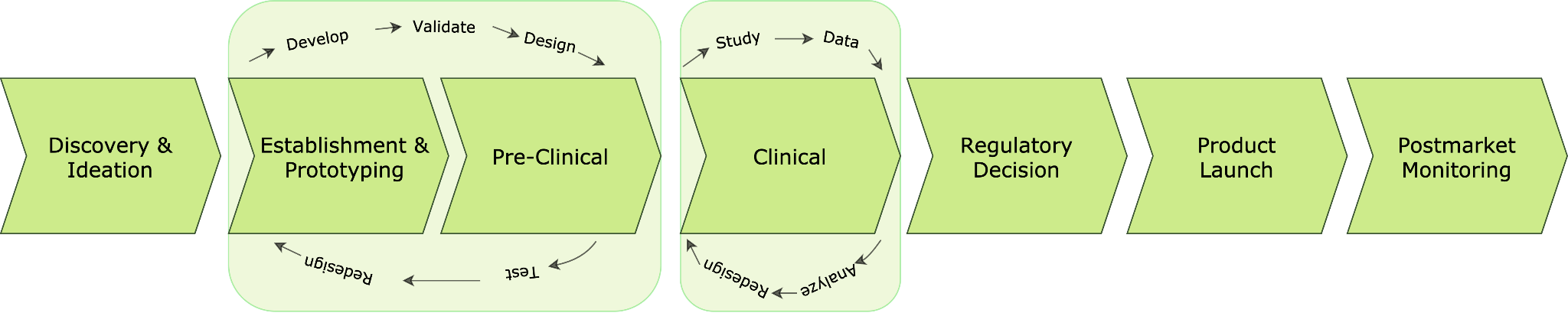
Abb. 1 - Entwicklungsweg von Gesundheitsprodukten von der Entdeckung und Idee bis zur Markteinführung und Überwachung nach der Markteinführung gemäß FD
Die Spezifikationen der IEC 62304 gelten nur für die Komponentenebene des eingebetteten medizinischen Personensystems und darunter. Validierung ist definiert als "Beurteilung, ob ein Produkt die Anforderungen für den vorgesehenen Gebrauch erfüllt" (IEC 60601-1) [3] und "Bestätigung [...], dass die Anforderungen für einen bestimmten vorgesehenen Gebrauch oder eine bestimmte vorgesehene Anwendung erfüllt wurden" (ISO 13485/ISO 9001) [5]. Das heißt, die Validierung erfordert eine klar definierte erwartete Verwendung und gültige Verwendungsanforderungen. Prüfszenarien für das gesamte Medizinprodukt müssen daher alle Spezifikationen für die Anwendung nach IEC 62366 [6] abdecken und alle wesentlichen Aufgaben und alle risikobehafteten Arbeitsschritte prüfen. Soweit sich die IEC 62304 [1] auf die in Medizinprodukten eingebettete Software konzentriert, sind die Anforderungen nur für die Softwareverifikation, nicht aber für die Validierung formuliert. Hierfür sollten Hersteller von Medizinprodukten die IEC 60601-1 [3] oder die IEC 82304 ("Health Software") [7] heranziehen, die den oberen Teil des V-Modells in der Abbildung abdeckt und auch für sogenannte Stand-alone-Software gilt.
Lebenszyklus der Softwareentwicklung
Die Norm IEC 62304 [1] enthält eine Struktur des Lebenszyklusprozesses und Anforderungen für jede Lebenszyklusphase. Das V-Modell der Softwareentwicklung wird in Übereinstimmung mit dieser Norm dargestellt (Abb. 2).
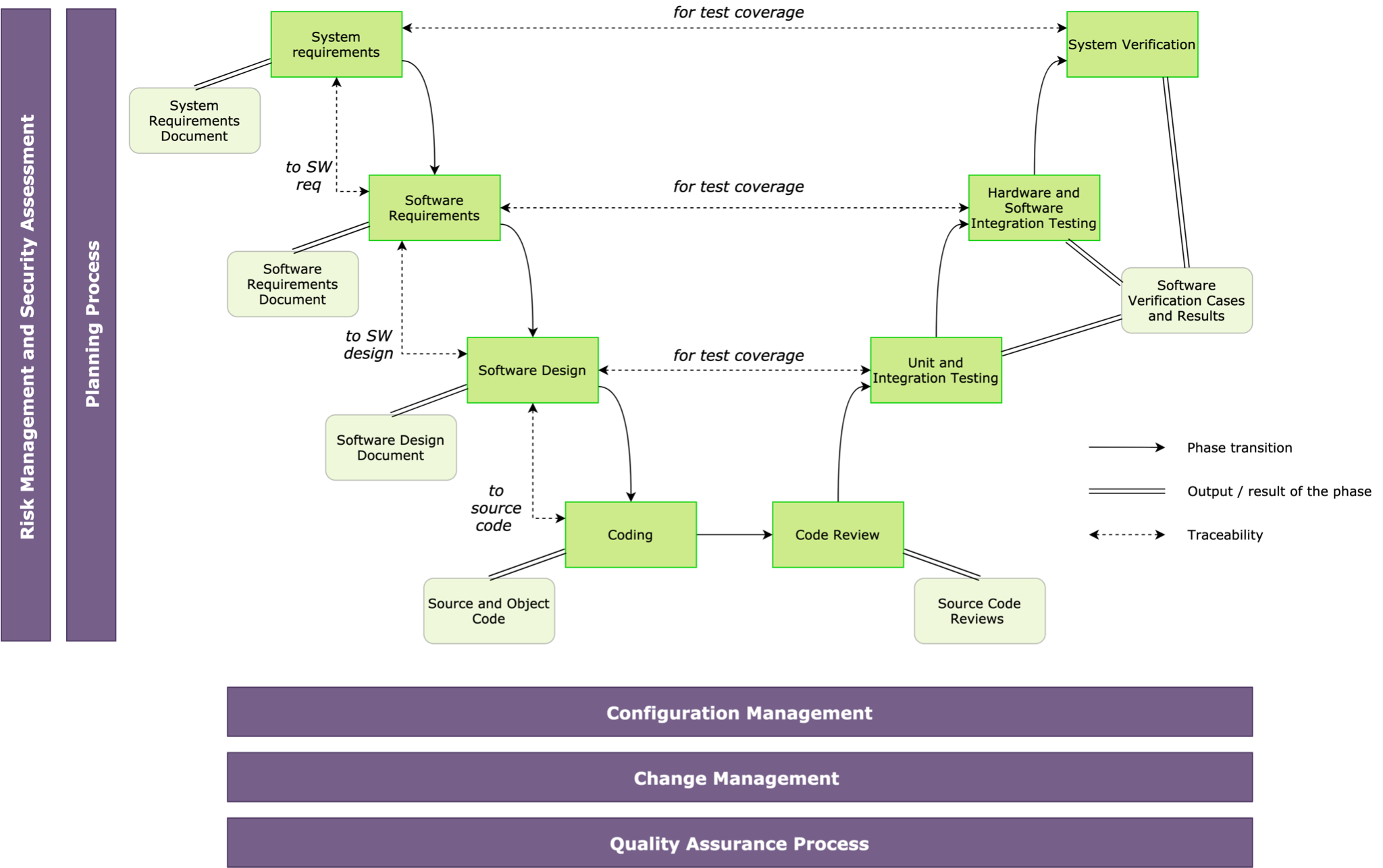
Abb. 2 - Lebenszyklus medizinischer Software nach IEC 6230
Das Diagramm zeigt die Phasen, Ergebnisse, Verbindungen und Aktivitäten des Lebenszyklus von Software im Gesundheitswesen. Der Lebenszyklus wird durch einen Planungsprozess definiert, der einen vereinbarten Satz von Plänen und Standards verwendet, um Aktionen und Phasen zu beschreiben. Der Lebenszyklus wird durch einen Konfigurationsmanagementprozess, einen Änderungsmanagementprozess und eine Softwarequalitätssicherung unterstützt. Ein wichtiger Bestandteil dieses Lebenszyklus sind die Maßnahmen zur Risiko- und Sicherheitsbewertung, die potenzielle Gefahren ermitteln und zur Bestimmung der Sicherheitsklasse der betreffenden Komponente führen.
Rückverfolgbarkeit von Anforderungen
Die Rückverfolgbarkeit von Software ist für die Entwicklung von Software für das Gesundheitswesen von zentraler Bedeutung und wird für die behördliche Zulassung benötigt. Das Dokument "General Principles of Software Validation; Final Guidance for Industry and FDA Staff" der US-amerikanischen Gesundheitsbehörde CDRH enthält Leitlinien für die Validierung und Rückverfolgbarkeit bei der Entwicklung von Software für Gesundheitsprodukte. Im Hauptteil des Dokuments wird betont, dass die Rückverfolgbarkeit eine wichtige Aktivität ist, die die endgültige Entscheidung, dass die Software validiert wurde, unterstützt. In Abschnitt 3.1.2 heißt es: "Die Validierung von Software beinhaltet typischerweise den Nachweis, dass alle Softwareanforderungen korrekt und vollständig implementiert wurden und zu den Systemanforderungen rückverfolgbar sind". In Abschnitt 3.2 heißt es: "Die Softwarevalidierung umfasst die Bestätigung der Konformität mit allen Softwarespezifikationen und die Bestätigung, dass alle Softwareanforderungen zu den Systemspezifikationen rückverfolgbar sind". In Abschnitt 5 des Dokuments wird dann hervorgehoben, dass die Rückverfolgbarkeit ein entscheidender Faktor für fast alle Softwareentwicklungsprozesse ist, insbesondere in Bezug auf Anforderungen, Design, Konstruktion und Testprozesse.
Abb. 3 zeigt ein Diagramm zur Verfolgung der Anforderungen an Produkte des Gesundheitswesens in jeder Phase des Lebenszyklus der Softwareentwicklung, einschließlich Risiko- und Änderungsmanagement.
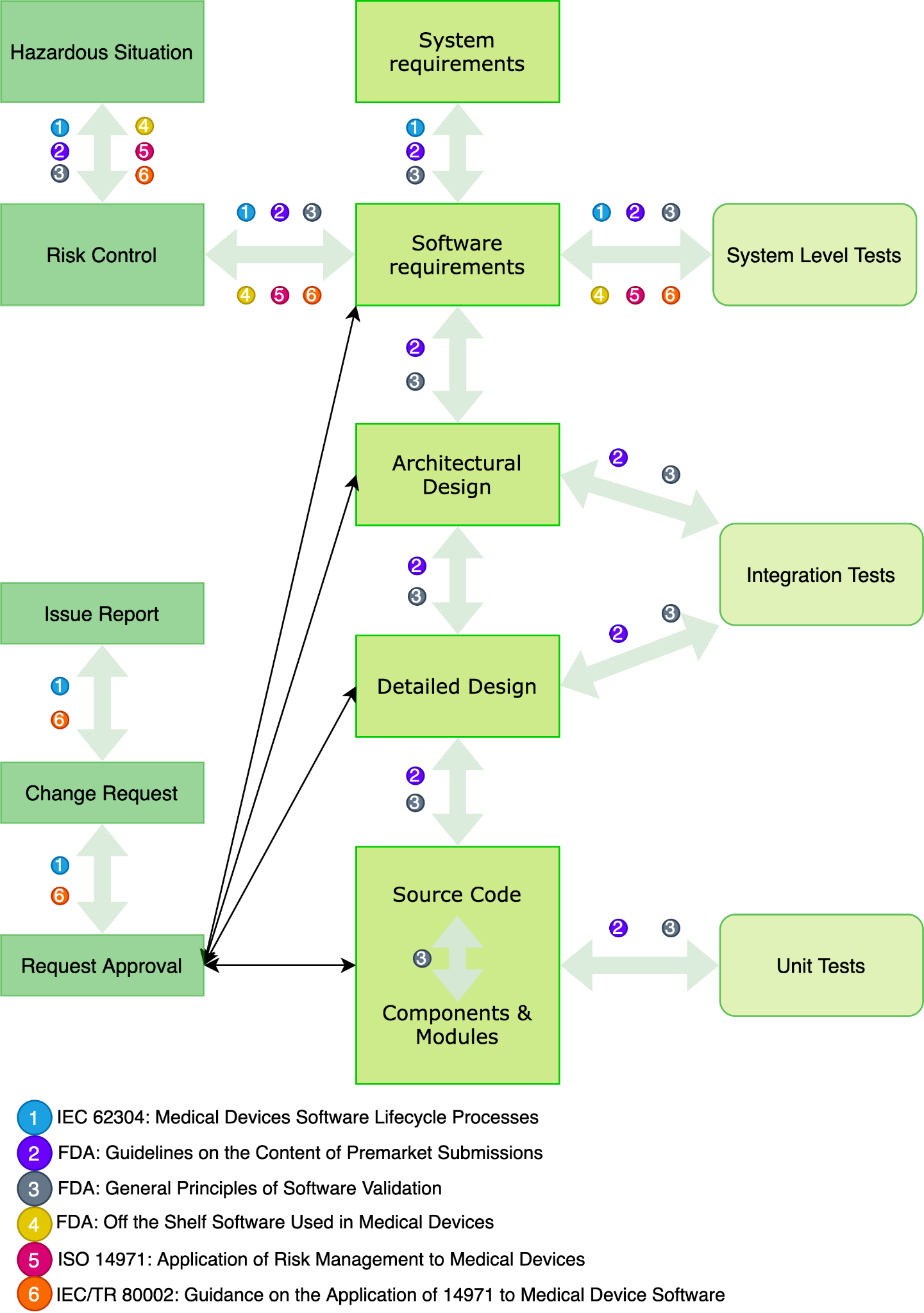
Abb. 3 - Schema für die Rückverfolgbarkeit von Anforderungen an Gesundheitsprodukte [9]
Schlussfolgerung
Ein effektiver Prozess ist bei der Entwicklung von Software für das Gesundheitswesen von großer Bedeutung, da es sich hierbei um einen unternehmens- und sicherheitskritischen Bereich handelt. Die Anforderungen an einen effektiven Prozess werden durch eine große Anzahl von Industriestandards, Vorschriften und Richtlinien bestimmt und vorgeschrieben. Werden die Empfehlungen und Richtlinien nicht befolgt, müssen rückwirkend Dokumentationen und andere Maßnahmen wie Risikobewertungen oder Bewertungen der Benutzerfreundlichkeit erstellt werden, was zu unerwarteten Designänderungen, Verzögerungen bei der Softwarefreigabe und kommerziellen Verzögerungen bei der Markteinführung führen kann.
Referenzen
- IEC 62304. Medical Device Software - Software Life Cycle Processes.
- FDA: Appropriate Use of Voluntary Consensus Standards in Premarket Submissions for Medical Devices.
- IEC 60601. Medical electrical equipment. General requirements for basic safety and essential performance.
- ISO 14971. Medical devices -- Application of risk management to medical devices.
- ISO 13485. Medical devices -- Quality management systems -- Requirements for regulatory purposes.
- IEC 62366. Medical devices --Application of usability engineering to medical devices.
- IEC 82304. Health software.
- FDA: General Principles of Software Validation; Final Guidance for Industry and FDA Staff.
- Regan, G., Mc Caffery, F., Mc Daid, K., & Flood, D. (2013). Medical device standards’ requirements for traceability during the software development lifecycle and implementation of a traceability assessment model. Computer Standards & Interfaces, 36(1), pp. 3–9.
Categories
About the author
Share
Benötigen Sie einen Projektkostenvoranschlag?
Schreiben Sie uns, und wir bieten Ihnen eine qualifizierte Beratung.